Kunci Jawaban
Kunci Jawaban dan Pembahasan Mapel Kimia Kelas 12 SMA/MA Halaman 36, Uji Kompetensi A Pertanyaan 3
Berikut ini kunci jawaban dan pembahasan Kimia kelas 12 SMA/MA halaman 36, Uji Kompetensi A pada Pertanyaan 3 yang dapat dipelajari bersama-sama.
Penulis: Siti Umnah | Editor: pairat
SRIPOKU.COM - Berikut ini disajikan kunci jawaban mata pelajaran (mapel) Kimia kelas 12 SMA/MA halaman 36 semester 1.
Kunci jawaban Kimia kelas 12 SMA/MA halaman 36 ini akan membahas Pertanyaan 3 pada soal Uji Kompetensi A pada materi Bab 1 yakni Fenomena Sifat Koligatif Larutan.
Selain kunci jawaban, artikel ini menyediakan pembahasan yang mudah dipahami oleh siswa kelas 12 SMA/MA.
Baca juga: 10 Soal Penilaian Harian Biologi Kelas 10 SMA/MA Beserta Kunci Jawaban Lengkap dengan Pembahasan
Pada Buku Aktif Belajar Kimia untuk SMA&MA Kelas XII siswa akan mengerjakan soal Uji Kompetensi A.
Siswa diharapkan mengerjakan soal secara mandiri terlebih dahulu sebelum melihat kunci jawaban dan pemabahasan.
Untuk itu, simak kunci jawaban soal Kimia kelas 12 SMA/MA halaman 36 Pertanyaan 3 Uji Kompetensi A.
Baca juga: Kunci Jawaban dan Pembahasan Mapel Kimia Kelas 12 SMA/MA Halaman 36, Uji Kompetensi A Pertanyaan 2
Uji Kompetensi A, Halaman 36, Bab 1 Fenomena Sifat Koligatif Larutan
Pertanyaan 3
Rumus dan Petunjuk Pengerjaan
Berdasarkan teori :
- Sifat larutan yang tergantung pada jumlah partikel zat terlarut dan tidak tergantung pada sifat zat terlarut dikatakan Sifat Koligatif Larutan. Untuk Koligatif berasal dari bahasa latin yaitu colligarae yang artinya bergabung bersama. Ada empat macam sifat koligatif larutan, yaitu penurunan tekanan uap larutan jenuh, penurunan titik beku, kenaikan titik didih, dan tekanan osmotik.
- Suhu yang cairan dan zat padat suatu zat memiliki tekanan uap yang sama disebut titik beku. Serta penambahkan zat terlarut dalam pelarut dapat menyebabkan penurunan tekanan uap.
- Suhu dimana tekanan uap cairan menjadi sama dengan tekanan atmosfer disebut titik didih. Dan penambahan zat terlarut yang tidak mudah menguap dalam suatu pelarut menyebabkan penurunan tekanan uap.
- Dapat dilihat kurva suhu tekanan uap untuk larutan terletak dibawah kurva untuk pelarut murni.
- Penurunan titik beku ialah selisih antara larutan titik beku deng titik beku larutan. Penurunan titiki beku terjadi karena adanya penambahan zat terlarut.
- Kenaikan titik didih adalah larutan yang terbentuk harus dipanaskan hingga suhu yang lebih tinggi, sehingga tekanan uapnya menjadi sama dengan tekanan atmosfer.
- Penurunan tekanan uap jika semakin mudah molekul-molekul zat cair berubah menjadi uap maka semakin tinggi tekanan uap zat cair.
- Zat terlarut yang bersifat non-volatif (tidak mudah menguap; tekanan uapnya tidak dapat terukur), tekanan uap dari larutan akan selalu lebih rendah dari tekanan uap pelarut murni yang volatile.
- Contoh tekanan osmosis dapat dilihat dari ketika dua larutan yang berbeda dipisahkan oleh suatu membrane semipermeable (membran yang hanya dapat dilewati partikel pelarut namun tidak dapat dilewati partikel zat terlarut).
- Sifat koligatif larutan memahami tiga konsep yaitu : Konsep larutan, Senyawa elektroit dan noneletrolit, Konsentrasi.
- Rumus yang digunakan dalam sifat koligatif larutan ialah :
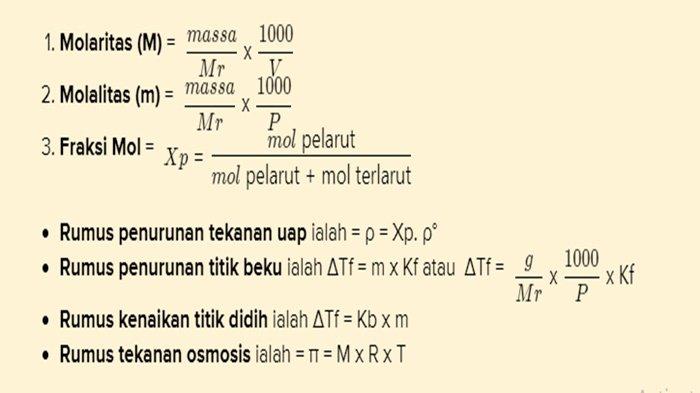
Jawaban dan Pembahasan Soal
Ditanya : Tekanan uap berbanding lurus dengan ?
Berdasarkan teori diatas maka dapat dikatakan salah satu sifat dari koligatif larutan ialah tekanan uap larutan jenuh. Rumus dari tekanan larutan uap ialah
ρ = Xp. ρ°
Jika dilihat keterangan
ρ° = tekanan uap jenuh pelarut murni
Xp = fraksi mol
ρ = tekanan uap jenuh larutan.
Maka dapat dikatakan tekanan uap berbanding lurus dengan fraksi mol dan tekanan uap jenuh larutan. Pilihan diopsi tidak ada tekanan uap jenuh larutan maka fraksi mol yang dijabarkan rumusnya. Dapat dilihat rumus dari fraksi mol ialah

Setelah dijabarkan maka dapat dilihat bahwa
- tekanan uap berbanding lurus dengan mol pelarut
- berbanding terbalik dengan mol terlarut.
Dapat dirangkum dari rumus tekanan uap ialah :
- tekanan uap berbanding lurus dengan tekanan uap jenuh larutan
- tekanan uap berbanding lurus dengan fraksi mol
- tekanan uap berbanding lurus dengan mol pelarut
- tekanan uap berbanding terbalik dengan mol terlarut
Jawaban Akhir dan Kesimpulan
Dapat disimpulkan dari penjabaran teori maka tekanan uap berbanding lurus dengan fraksi mol pelarut (A)
kunci jawaban
Uji Kompetensi A
Pertanyaan 3
Fenomena Sifat Koligatif Larutan
Kimia kelas 12 SMA/MA halaman 36
Sripoku.com
| 45 Soal SAS IPS Kelas 8 SMP Kurikulum Merdeka 2025/2026, Lengkap Kunci Jawaban |
:format(webp):focal(0.5x0.5:0.5x0.5)/palembang/foto/bank/originals/SAS-IPS-Kelas-8-SMP-Semester-1.jpg)
|
|---|
| Latihan Soal dan Kunci Jawaban PAI Kelas 7 SMP Halaman 75 Kurikulum Merdeka |
:format(webp):focal(0.5x0.5:0.5x0.5)/palembang/foto/bank/originals/kunci-jawaban-latihan-soal-PAI-kelas-7-SMP-Kurikulum-Merdeka.jpg)
|
|---|
| Latihan Soal dan Kunci Jawaban PAI Kelas 7 SMP Halaman 71 Kurikulum Merdeka |
:format(webp):focal(0.5x0.5:0.5x0.5)/palembang/foto/bank/originals/kunci-jawaban-latihan-soal-PAI-kelas-7-SMP-Kurikulum-Merdeka.jpg)
|
|---|
| Latihan Soal dan Kunci Jawaban PAI Kelas 7 SMP Halaman 67 Kurikulum Merdeka |
:format(webp):focal(0.5x0.5:0.5x0.5)/palembang/foto/bank/originals/kunci-jawaban-latihan-soal-PAI-kelas-7-SMP-Kurikulum-Merdeka.jpg)
|
|---|
| Latihan Soal dan Kunci Jawaban PAI Kelas 7 SMP Halaman 63 Kurikulum Merdeka |
:format(webp):focal(0.5x0.5:0.5x0.5)/palembang/foto/bank/originals/kunci-jawaban-latihan-soal-PAI-kelas-7-SMP-Kurikulum-Merdeka.jpg)
|
|---|
:quality(30):format(webp):focal(0.5x0.5:0.5x0.5)/palembang/foto/bank/originals/Gambar-pada-soal-Kimia-kelas-12-Pertanyaan-3.jpg)
:format(webp):focal(0.5x0.5:0.5x0.5)/palembang/foto/bank/originals/Modul-Ajar-Deep-Learning-PAIBP-Kelas-7-SMP-Terbaru.jpg)









:format(webp):focal(0.5x0.5:0.5x0.5)/palembang/foto/bank/originals/Dalam-Ujian-Matematika-Pak-Andi-Memperbolehkan-Menggunakan-Kalkulator.jpg)
:format(webp):focal(0.5x0.5:0.5x0.5)/palembang/foto/bank/originals/Bab-4-Modul-Ajar-Deep-Learning-Informatika.jpg)
:format(webp):focal(0.5x0.5:0.5x0.5)/palembang/foto/bank/originals/Bahasa-Indonesia-kelas-9-SMP-halaman-115-Kurikulum-Merdeka-Jurnal-Membaca.jpg)
:format(webp):focal(0.5x0.5:0.5x0.5)/palembang/foto/bank/originals/Jawaban-UKPPPG-2025-Modul-1-Topik-1-PPG-2025.jpg)
:format(webp):focal(0.5x0.5:0.5x0.5)/palembang/foto/bank/originals/28-soal-Bahasa-Inggris-kelas-4.jpg)
Isi komentar sepenuhnya adalah tanggung jawab pengguna dan diatur dalam UU ITE.