Kunci Jawaban
Kunci Jawaban dan Pembahasan Mapel Kimia Kelas 12 SMA/MA Halaman 36, Uji Kompetensi A Pertanyaan 4
Berikut ini kunci jawaban dan pembahasan Kimia kelas 12 SMA/MA halaman 36, Uji Kompetensi A pada Pertanyaan 4 yang dapat dipelajari bersama-sama.
Penulis: Siti Umnah | Editor: adi kurniawan
SRIPOKU.COM - Berikut ini disajikan kunci jawaban mata pelajaran (mapel) Kimia kelas 12 SMA/MA halaman 36 semester 1.
Dimana kunci jawaban Kimia kelas 12 SMA/MA halaman 36 ini akan membahas Pertanyaan 4 pada soal Uji Kompetensi A pada materi Bab 1 yakni Fenomena Sifat Koligatif Larutan.
Selain kunci jawaban, artikel ini menyediakan pembahasan yang mudah dipahami oleh siswa kelas 12 SMA/MA.
Baca juga: Pembahasan Kunci Jawaban Fisika Kelas 12 SMA/MA Halaman 135, Uji Kompetensi A Pertanyaan 1 Bab 4
Pada Buku Aktif Belajar Kimia untuk SMA&MA Kelas XII siswa akan mengerjakan soal Uji Kompetensi A.
Siswa diharapkan mengerjakan soal secara mandiri terlebih dahulu sebelum melihat kunci jawaban dan pemabahasan.
Untuk itu, simak kunci jawaban soal Kimia kelas 12 SMA/MA halaman 36 Pertanyaan 4 Uji Kompetensi A.
Baca juga: Kunci Jawaban dan Pembahasan Mapel Kimia Kelas 12 SMA/MA Halaman 36, Uji Kompetensi A Pertanyaan 3
Uji Kompetensi A, Halaman 36, Bab 1 Fenomena Sifat Koligatif Larutan
Pertanyaan 4
Rumus dan Petunjuk Pengerjaan
Berdasarkan teori :
- Sifat larutan yang tergantung pada jumlah partikel zat terlarut dan tidak tergantung pada sifat zat terlarut dikatakan Sifat Koligatif Larutan. Untuk Koligatif berasal dari bahasa latin yaitu colligarae yang artinya bergabung bersama. Ada empat macam sifat koligatif larutan, yaitu penurunan tekanan uap larutan jenuh, penurunan titik beku, kenaikan titik didih, dan tekanan osmotik.
- Suhu yang cairan dan zat padat suatu zat memiliki tekanan uap yang sama disebut titik beku. Serta penambahkan zat terlarut dalam pelarut dapat menyebabkan penurunan tekanan uap.
- Suhu dimana tekanan uap cairan menjadi sama dengan tekanan atmosfer disebut titik didih. Dan penambahan zat terlarut yang tidak mudah menguap dalam suatu pelarut menyebabkan penurunan tekanan uap.
- Dapat dilihat kurva suhu tekanan uap untuk larutan terletak dibawah kurva untuk pelarut murni.
- Penurunan titik beku ialah selisih antara larutan titik beku deng titik beku larutan. Penurunan titiki beku terjadi karena adanya penambahan zat terlarut.
- Kenaikan titik didih adalah larutan yang terbentuk harus dipanaskan hingga suhu yang lebih tinggi, sehingga tekanan uapnya menjadi sama dengan tekanan atmosfer.
- Penurunan tekanan uap jika semakin mudah molekul-molekul zat cair berubah menjadi uap maka semakin tinggi tekanan uap zat cair.
- Zat terlarut yang bersifat non-volatif (tidak mudah menguap; tekanan uapnya tidak dapat terukur), tekanan uap dari larutan akan selalu lebih rendah dari tekanan uap pelarut murni yang volatile.
- Contoh tekanan osmosis dapat dilihat dari ketika dua larutan yang berbeda dipisahkan oleh suatu membrane semipermeable (membran yang hanya dapat dilewati partikel pelarut namun tidak dapat dilewati partikel zat terlarut).
- Sifat koligatif larutan memahami tiga konsep yaitu : Konsep larutan, Senyawa elektroit dan noneletrolit, Konsentrasi.
- Rumus yang digunakan dalam sifat koligatif larutan ialah :
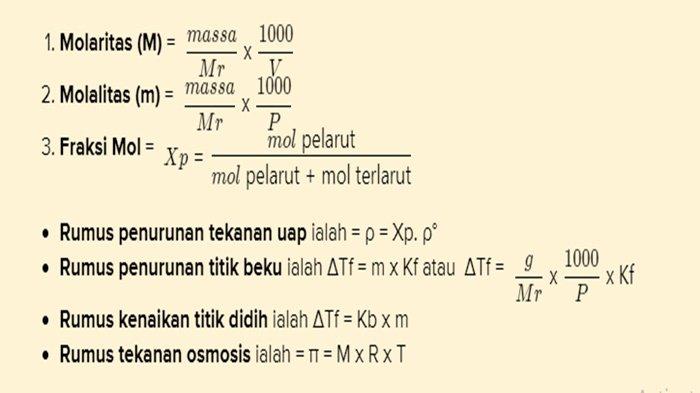
Jawaban dan Pembahasan Soal
Ditanya : penurunan titik beku yang dihasilkan oleh satu mol zat nonelektrolit ialah?
Berdasarkan teori diatas yang menyatakan bahawa penurunan titik beku terjadi karena selisih antara larutan titik beku dengan titik beku larutan yang disebabkan karena adanya penambahan zat terlarut.
Sesuai rumus ialah ΔTf = m x Kf

Sesuai keterangan bahwa
ΔTf = penurunan titik beku
g = massa zat terlarut (gram)
p = massa pelarut (gram)
Kf = tetapan penurunan titik beku molal (°C/m)
Karena ditanya 1 mol maka berapa masa pelarut. setelah diketahui rumus dan satuan dari penurunan titik beku maka dapat dikatakan satuan ialah gram.
jika 1 mol maka jika diubah ke gram ialah 1000. Oleh karena itu 1 mol penurunan titik beku maka 1000 gram pelarut
Jawaban Akhir dan Kesimpulan
Dapat disimpulkan bahwa 1 mol penurunan titik beku maka 1000 gram pelarut (D)
Uji Kompetensi A
kunci jawaban
Pertanyaan 4
Fenomena Sifat Koligatif Larutan
Kimia kelas 12 SMA/MA halaman 36
Sripoku.com
Pembahasan
| 20 Latihan Soal Sumatif Tengah Semester 1 Pendidikan Pancasila Kelas 6 SD Kurikulum Merdeka |

|
|---|
| Kunci Jawaban PAI Kelas 5 SD Halaman 66 Kurikulum 2013 Semester 1, Latihan Ayo Berlatih Pelajaran 7 |

|
|---|
| Kunci Jawaban PAI Kelas 5 SD Halaman 57 Kurikulum 2013 Semester 1, Soal Ayo Berlatih Pelajaran 6 |

|
|---|
| Kunci Jawaban PAI Kelas 5 SD Halaman 47 Kurikulum 2013 Semester 1, Latihan Ayo berlatih Pelajaran 5 |

|
|---|
| Kunci Jawaban PAI Kelas 5 SD Halaman 47 Kurikulum 2013 Semester 1, Latihan Soal Tugasku Pelajaran 5 |

|
|---|















Isi komentar sepenuhnya adalah tanggung jawab pengguna dan diatur dalam UU ITE.